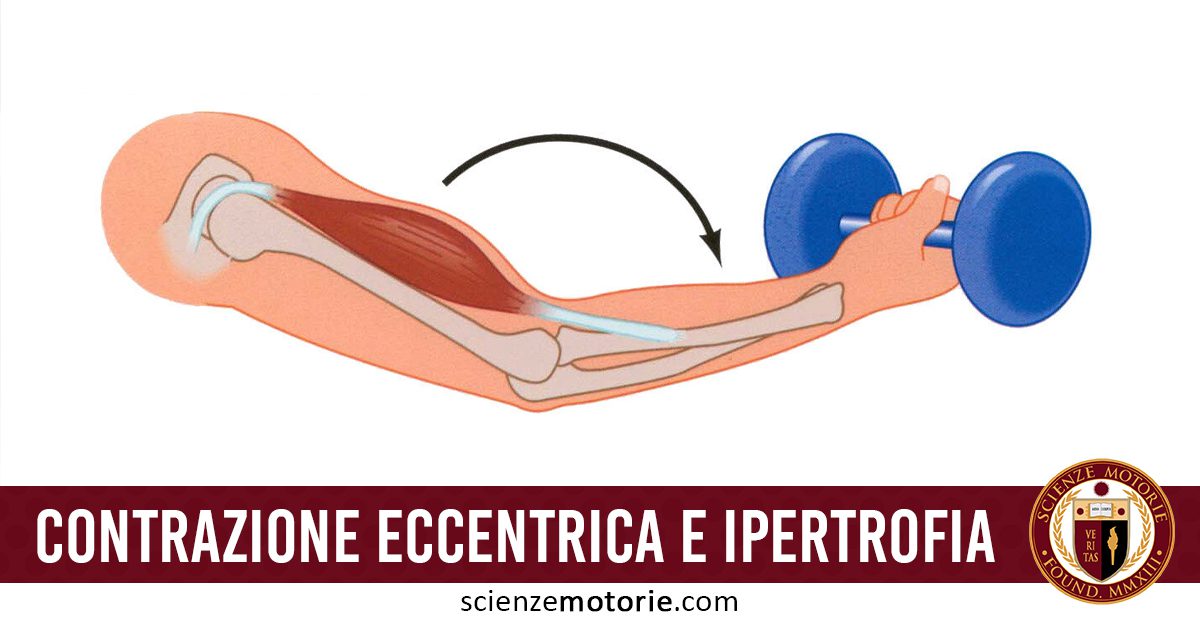
La massima forza sviluppabile durante la contrazione eccentrica è superiore del 13,5% e del 39,7% rispetto alla massima forza sviluppabile durante la contrazione isometrica e concentrica rispettivamente (Doss et al., 1965).
Sebbene il meccanismo esatto attraverso il quale gli esercizi di resistenza stimolano incrementi di forza e ipertrofia sia ancora sconosciuto, la ricerca indica che la componente eccentrica della contrazione è essenziale per favorire incrementi di forza e l’accrescimento muscolare.
A parità di carico esterno utilizzato, durante la contrazione eccentrica viene coinvolto un numero di unità motorie inferiore rispetto alla contrazione concentrica (Eloranta et al., 1980).
Ciò crea più stress meccanico sui ponti trasversali actomiosinici causando, in tal modo, danno sui sarcomeri ed i tessuti circostanti (Armstrong, 1984; Brown et al., 1997).
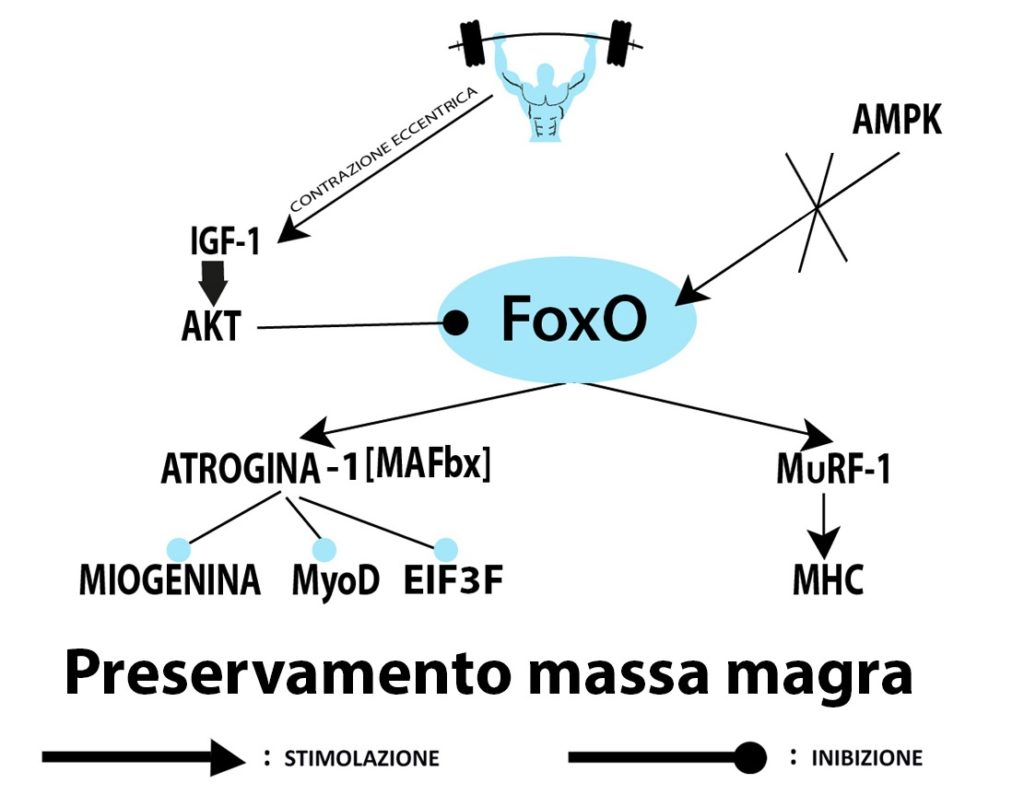
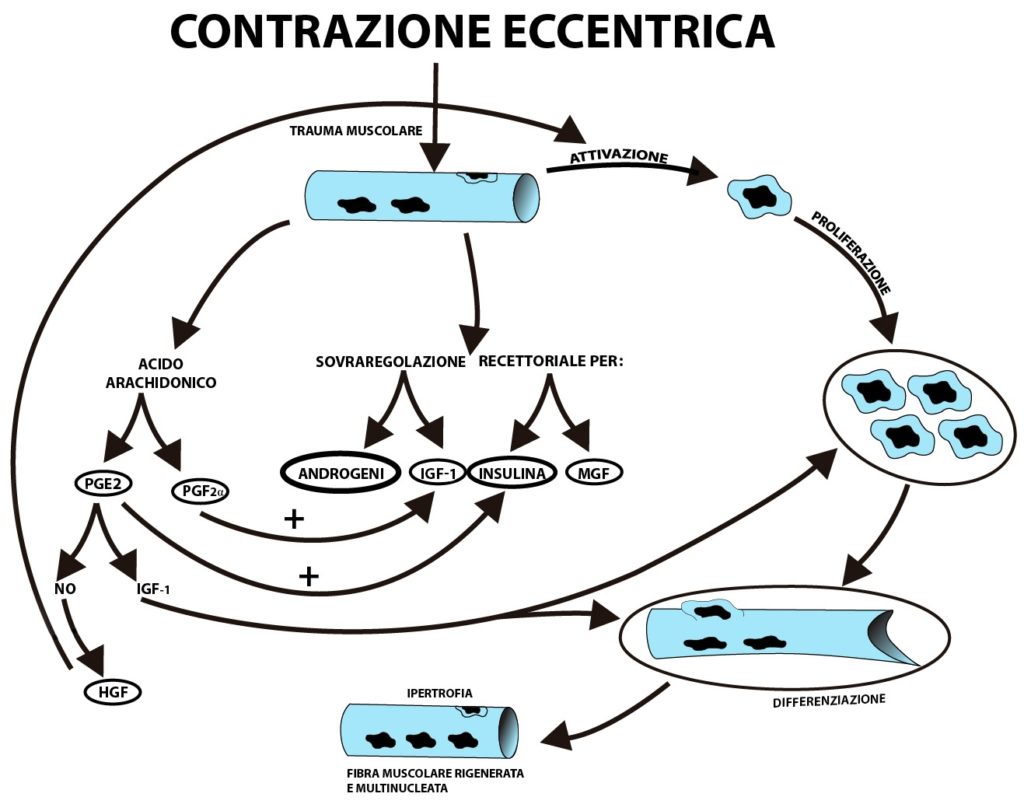
Il trauma muscolare derivante dalla contrazione eccentrica “attiva” le cellule satellite (cellule dormienti dislocate sulla superficie delle fibre muscolari scheletriche mature) facendole entrare nel ciclo cellulare. Subito dopo, segue lo stadio della “proliferazione” nel quale le cellule satellite si dividono e moltiplicano.
Alla proliferazione segue la “differenziazione”, stadio nel quale le cellule satellite si fondono alle cellule muscolari danneggiate donandole i loro nuclei. Si formano cellule muscolari con un contenuto superiore di DNA. Maggiore è il numero di nuclei all’interno della fibra muscolare più è grande il potenziale di crescita della stessa.
Rapporto nucleo-citoplasma
Ciò è dovuto ad un meccanismo regolatorio restrittivo indicato come “rapporto nucleo-citoplasma” (Sinha-Hikim et al., 2003; Kadi et al., 1999).
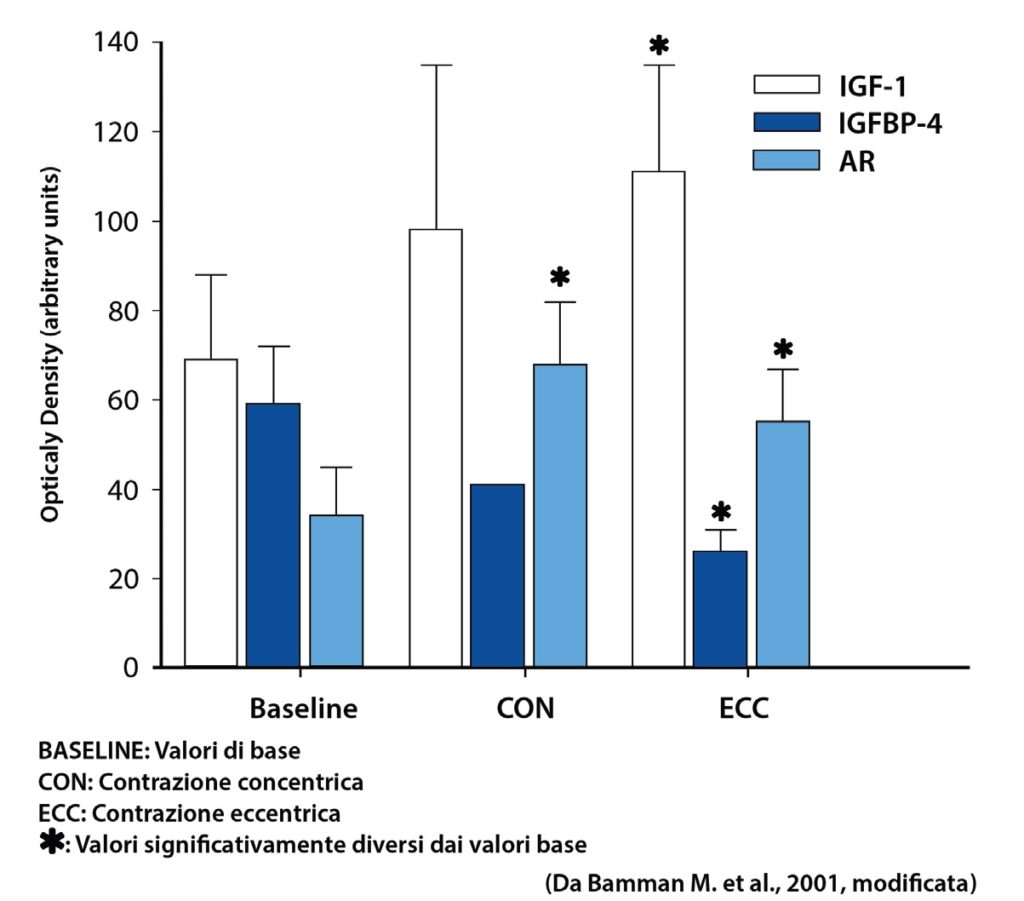
Questo significa che se una fibra muscolare presenta più nuclei, ad essa deve seguire una adeguata espansione citoplasmatica (o sarcoplasmatica), ed il risultato finale è un aumento delle sue dimensioni (ipertrofia). Questo è un passaggio importante per comprendere il potenziale anabolico della contrazione eccentrica mediata dalla liberazione di IGF-1 e non solo.
Il processo attraverso il quale la componente eccentrica della contrazione danneggia i miofilamenti deve essere ancora chiarito; ma si suppone sia dovuto all’azione di “frenata” del movimento proprio della componente eccentrica che determina un distacco forzato e violento dei ponti trasversali tra i filamenti di actina e miosina, dalla conseguente alterazione dell’omeostasi dei livelli di calcio intracellulari che favorisce il rilascio di enzimi proteolitici che a loro volta determinano ulteriore danno al sarcolemma (membrana cellulare della fibra muscolare) attraverso la produzione di leucotrieni, prostaglandine e radicali liberi (Armstrong, 1990). Tutto inizia con la rottura dello strato fosfolipidico della cellula muscolare (Armstrong, 1990).
In seguito al trauma allenante, in particolare quello indotto dalla contrazione eccentrica, vi è il rilascio di fosfolipasi. Queste portano al rilascio di alcuni fosfolipidi propri dello strato esterno della cellula muscolare.
Acido arachidonico
L’acido arachidonico viene rilasciato in seguito al trauma muscolare; viene convertito immediatamente e localmente in prostaglandine ad opera delle ciclossigenasi.
Le prostaglandine PGE2 e PGF2α hanno spiccata attività anabolica. Le PGE2 giocano un ruolo cruciale sulla sintesi di ossido nitrico e quest’ultimo sul rilascio del fattore di crescita HGF (Tatsumi et al., 2002; Takahashi et al., 1996).
L’HGF in seguito a trauma muscolare migra verso le cellule satellite “attivandole” e facendole entrare nel ciclo cellulare.
Le PGF2α sovraregolano l’espressione dei recettori locali per l’IGF-1 (Harada et al., 1995; Hakeda et al., 1991).
Invece, le PGE2 incrementano la sintesi locale di IGF-1 (McCarthy et al., 1991).
Inoltre le PGE2, presenti in risposta a trauma muscolare, sovraregolano l’espressione dei recettori all’insulina (Ivy, 1987; Leighton et.al., 1990).
Questo ultimo punto spiegherebbe diverse cose, tra le quali anche:
- l’effetto insulino sensibilizzante dell’allenamento pesi;
- il maggior potere anabolico e meno lipogenico dell’assunzione di una miscela di proteine e carboidrati in seguito ad allenamento pesi in soggetti sani.
L’incrementale sintesi di IGF-1 e sua aumentata espressione recettoriale in seguito alla cascata di eventi indotti da trauma muscolare eccentrico determinano proliferazione e differenziazione delle cellule satellite (Engert et al., 1996).
MGF
L’MGF, una variante dell’IGF-1 che si produce a livello locale del tessuto danneggiato in seguito a trauma eccentrico, favorisce la proliferazione delle cellule satellite (McKoy et al., 1999).
Anche gli FGF, una famiglia di fattori di crescita, sono coinvolti nei processi di proliferazione delle cellule satellite. E la loro espressione è proporzionale all’entità del trauma muscolare subito (Mitchell et al., 1999; Yamada et al., 1989).
L’FGF-2 e FGF-4 sembrerebbero i più rappresentativi della famiglia relativamente al tessuto muscolare adulto.
La complessa orchestra sinergica tra gli eventi ormonali ed enzimatici che occorrono in risposta al trauma muscolare fa comprendere quanto importante sia la contrazione eccentrica per l’ipertrofia.
Questo fa capire perché la contrazione eccentrica produca più incrementi di forza e ipertrofia rispetto alla concentrica (Roig et al., 2009). Ma altresì suggerisce con quale pressapochismo, mancanza di cognizione di causa e non competenza vengano gestiti gli allenamenti che pongono l’enfasi solo sul “sollevare” piuttosto che sull’“abbassare” il carico.
Vuoi sapere come?
Scoprilo al Corso di Nutrizione Funzionale >
Oppure acquista il libro >